ⓔコラム15-1-1 ホルモン濃度測定の発展
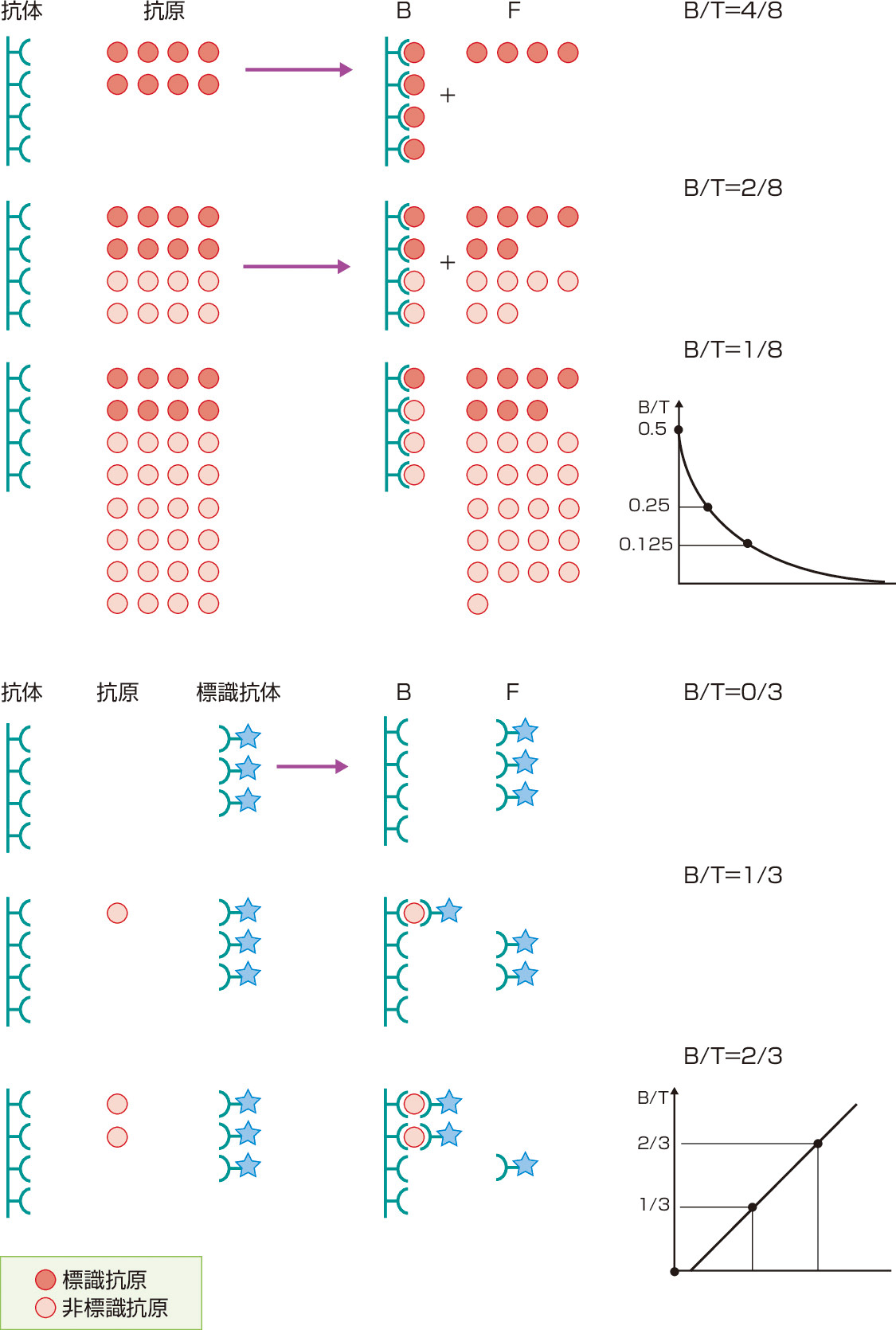
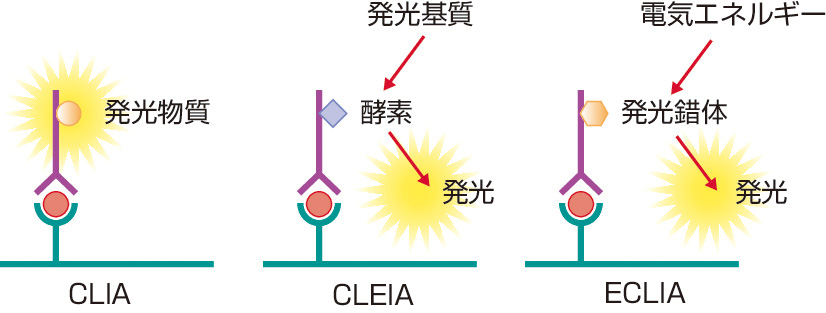
微量なホルモンが測定できなかった時代は,生物学的作用をin vitroの系で再現するバイオアッセイや副腎ステロイドの尿中排泄量を測定する比色法などが中心に行われていたが,煩雑さや感度・特異度の面で問題があった.ここに風穴をあけたのが,YalowとBersonらによる抗原抗体反応を利用したラジオイムノアッセイ (radioimmunoassay: RIA) の開発である (1959年).これによりピコモルオーダー (pM=10-12 M) の微量なホルモン測定が可能となり,内分泌学は大きく発展してきた.狭義のRIAは,固相化した抗体の測定系に,放射性同位元素で標識した抗原 (ホルモン) と検体を入れ,競合反応により検体中のホルモン濃度を求める方法である (図1).一方,イムノラジオメトリックアッセイ (immunoradiometric assay: IRMA) は,抗原と十分量の抗体を用いて,競合的な抗原抗体反応を起こさずに抗原となるホルモンを直接測定する方法で,より感度が高い (図1).1970年代に入り,放射性同位元素による標識に代わって酵素 (enzyme immunoassay: EIA) や化学発光 (chemiluminescent immunoassay: CLIA) による標識が用いられるようになり,試薬の安定性と,特別な施設が不要になったことから,利便性が格段に高まった.最近では感度の面から,酵素標識のなかでも化学発光基質添加による発光強度を測定するCLEIA (chemiluminescent enzyme immunoassay) が普及している.また,化学発光標識のなかでもルテニウム錯体標識抗体 (あるいは抗原) に対して電気化学反応による発光強度を測定するECLIA (electrochemiluminescent immunoassay) が,全自動化システムの導入により主流を占めるようになった (図2).しかし例えば,9つのアミノ酸からなる小ペプチドAVPについては,2つの異なるエピトープを認識する抗体の作成が困難なことから,その測定にいまなおRIAが用いられている.また,TSH受容体刺激型抗体の測定法としてin vitroの系でcAMPを測定するバイオアッセイ (EIAで測定) も行われている.一方で,イムノアッセイには感度や特異度の面でなお問題となることがあり,他の分析法として高速液体クロマトグラフィ (HPLC) や質量分析法 (mass spectrometry: MS) も臨床の現場で用いられる (ⓔ図15-1-1).これらは多項目を同時に測定できるメリットもある (カテコールアミン3分画など).
〔槙田紀子〕