ⓔコラム15-4-12 甲状腺癌の遺伝子変異と分子標的薬治療
進行性,転移性の甲状腺癌に対する薬物療法は皆無に近かったが,最近,さまざまな分子標的薬が登場してきた.わが国では現在,①ソラフェニブ,②レンバチニブ,③バンデタニブがそれぞれ,①未分化癌を除く甲状腺癌,②未分化癌を含む甲状腺癌,③髄様癌を適応として保険収載されている.いずれも根治切除不能であることが適応条件となっており,分化癌 (乳頭癌,濾胞癌,低分化癌) に対しては放射性ヨウ素 (RAI) 治療抵抗性であることが分子標的薬使用の前提となる.高リスク分化癌には早い段階で確実に甲状腺全摘と放射性ヨウ素内用療法が行われることが求められており,これらの標準治療に抵抗性でかつ進行が明らかな症例に対してのみ分子標的薬が考慮される.
また,分子標的薬の効果を最大限に活用するためには,適切なタイミングで治療を開始する判断とそれぞれの薬剤に特有の有害事象管理についてのチーム医療を前提とした知識と経験が求められる.
甲状腺癌の発生・増殖に関する分子機構
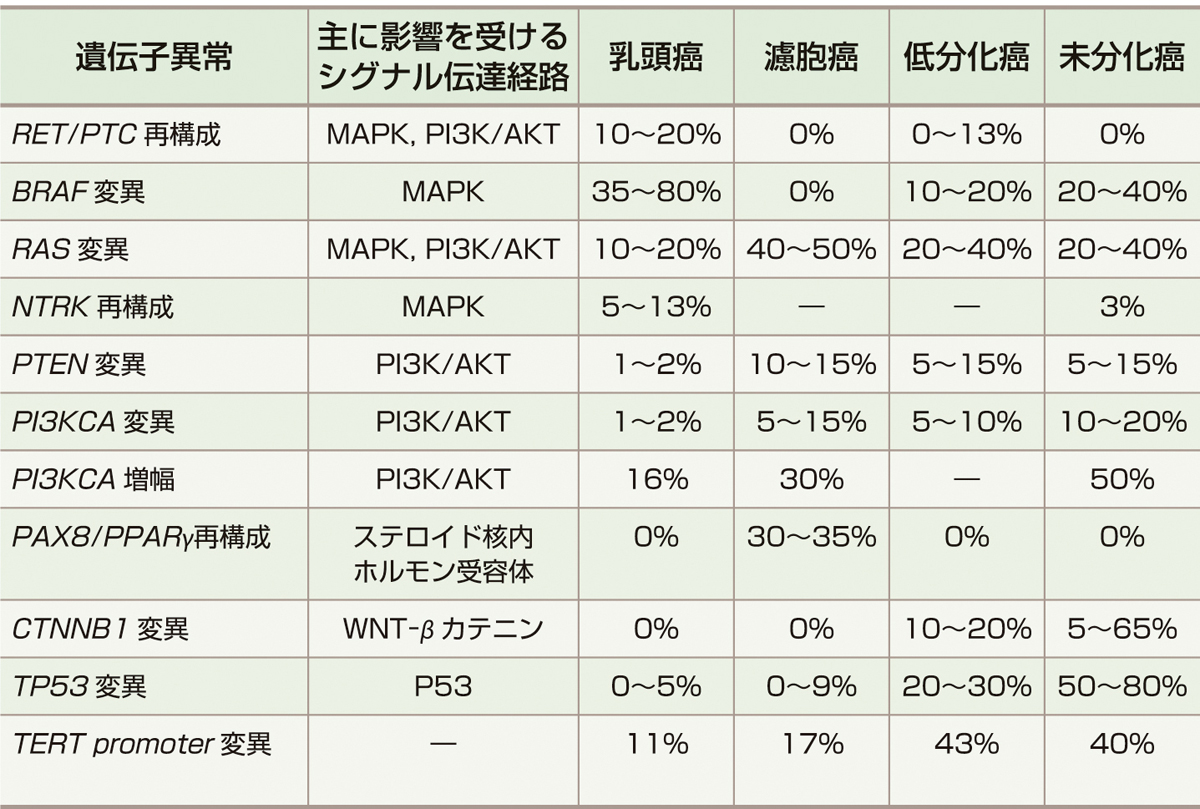
濾胞上皮細胞由来の甲状腺癌に認められる主な遺伝子異常を表1に示す1-3).これらの異常は受容体型チロシンキナーゼにリガンドが結合することで活性化されるRAS/RAF/mitogen–activated protein kinase (MAPK) 経路やPI3K/AKT経路といった細胞内シグナル伝達経路に存在する蛋白質をコードしている.これらの経路が遺伝子異常によって恒常的に活性化されることで,甲状腺癌の発生,増殖がもたらされると考えられている.また,MAPK経路やPI3K/AKT経路が活性化されるとVEGFシグナルネットワークを中心とする血管新生のメカニズムも活性化され,腫瘍の増殖,転移が生じやすくなる.
甲状腺癌の発生・増殖にかかわる分子生物学的背景が徐々に解明されてきたことから,MAPK経路や血管新生に関与するキナーゼを標的とした分子標的薬の開発が進められ,臨床試験が行われるようになった.
ソラフェニブ
ソラフェニブは血管新生にかかわるキナーゼ (VEGFR–1~3,PDGFR–β) および腫瘍増殖にかかわるキナーゼ (BRAF,RETなど) を阻害する経口分子標的薬 (400 mg,1日2回投与) で,肝細胞癌や腎細胞癌でも有効性が示されていた.国際共同・無作為化・二重盲検・プラセボ対照・第Ⅲ相臨床試験 (DECISION試験) で,RAI治療抵抗性の局所進行または転移性の分化癌 (低分化癌を含む) を対象として,その有効性および安全性が検証された4).登録前14カ月以内に病勢進行が確認されている症例に対し,プラセボ群210例の無増悪生存期間 (progression-free survival: PFS) の中央値が5.8カ月であったのに対し,ソラフェニブ群207例では10.8カ月と有意の延長を認めた (ハザード比:0.59,95%信頼区間:0.45~0.76).ソラフェニブ群における奏効率は12.2%であった.有害事象としては,手掌足底発赤知覚不全症候群 (手足症候群),脱毛,下痢,体重減少,疲労,高血圧,発疹の頻度が高かった.Grade 3以上で10%以上に認めたのは手足症候群のみであったが,まれにStevens–Johnson症候群などの重篤な皮膚障害,ケラトアカントーマや皮膚有棘細胞癌の発生が報告されている.
レンバチニブ
レンバチニブもまた血管新生にかかわるキナーゼ (VEGFR–1~3,FGFR–1~4など) および腫瘍増殖にかかわるキナーゼ (RET,KIT) を標的とする経口分子標的薬 (24 mg,1日1回投与) である.国際第Ⅲ相試験 (SELECT試験) において,登録前13カ月以内に病勢進行が確認されている症例 (中央判定) に対し,レンバチニブ群261例のPFS中央値は18.3カ月とプラセボ群131例の3.6カ月を有意に上回った (ハザード比:0.21,95%信頼区間:0.14~0.31).ソラフェニブを含むVEGFR標的治療歴を有する部分集団においてもPFS延長効果は有意であった.レンバチニブの奏効率は64.8%で完全奏効も4例 (1.5%) に認められた.有害事象では高血圧,下痢,疲労,食欲減退,体重減少,悪心,口内炎,手足症候群,蛋白尿が多かった.高血圧および蛋白尿はGrade 3以上の頻度が10%以上であった5).
バンデタニブ
バンデタニブはRET,VEGFR 2~3,EGFRを抑制する経口分子標的薬 (300 mg,1日1回投与) で,国際第Ⅲ相試験 (ZETA試験) において,局所進行性あるいは転移性の髄様癌に対する有効性が示された6).プラセボ群100例のPFSの中央値19.3カ月に対し,バンデタニブ群231例では中央値に達せず (推定30.5カ月),ハザード比は0.46 (95%信頼区間:0.31~0.69) と有意のPFS延長を認めた.バンデタニブ群における奏効率は45%,生化学的奏効率 (50%以上の低下) はカルシトニンで69%,CEAで52%であった.有害事象としては,下痢,発疹,悪心,高血圧,疲労などが多く,Grade 3以上では下痢,高血圧,心電図上のQT延長の頻度が高かった.
分子標的薬の適応選択と開始のタイミング
分化癌 (乳頭癌,濾胞癌,低分化癌) に対しては,転移再発病変が外科的根治切除不能でRAI治療抵抗性であり,他の治療 (放射線外照射など) の効果も期待できないこと,さらに明らかな病勢進行があることが分子標的薬使用の条件となる7).
RAI不応とは適切な前処置を行ったうえで治療を行い,①RAI集積のない病変があること,②RAIが集積しても増悪する病変があること,③累積線量で22.3 GBq (600 mCi) 以上の投与が行われていることのいずれかを満たす場合と解釈される.
RAI不応であっても分化癌の進行は遅いことが多く,たいていの患者は長く無症状で経過するため,分子標的薬の開始時期の決定には個別の十分な検討が必要となる.画像所見や血清サイログロブリン値の推移による進行速度の確認,臨床症状の程度や患者背景,外科的切除や放射線外照射あるいは緩和ケアなどその他の治療選択肢の可能性などを考慮したうえでの総合的判断が重要である.一般には3~6カ月ごとにCTなどの画像診断で腫瘍径と進行速度を観察する.サイログロブリン倍加時間も乳頭癌の予後予測に有用であるとされ,1年未満のものの予後は不良である8).
なお,分子標的薬に術前治療や術後補助療法としての役割はない.
分子標的薬治療と副作用管理
分子標的薬投与に伴いさまざまな有害事象が出現することがあり,減量・休薬が必要となることも多いが,治療による病勢制御のためには,治療強度を維持しての長期継続投与が肝要である.適切な副作用管理には,甲状腺・頭頸部外科医,腫瘍内科医はもとより皮膚科医,循環器内科医,腎臓内科医,放射線科医,看護師,薬剤師ら多職種診療チームによる患者教育も含めた支持体制が必須である.
特にソラフェニブで頻度の高い手足症候群については,投与開始前からの予防措置が有効とされる.保湿剤によって皮膚を保護し,乾燥,角化,角質肥厚を防ぐこと,手足の圧迫や刺激を避けること,必要に応じて厚くなった角質を取り除くことが推奨される.高血圧,蛋白尿に対してはアンジオテンシンⅡ受容体拮抗薬,アンジオテンシン変換酵素阻害薬のほかカルシウム拮抗薬などによる血圧管理を積極的に行う.
血管新生阻害作用のある分子標的薬には重大な副作用として創傷治癒遅延があり,通常手術後は2週間,針生検でも1週間の待機が望ましいとされる.また,分子標的薬の投与を契機に頸動脈などからの生命にかかわる大出血が起こることがあり,皮膚瘻孔・びらん・潰瘍,気管・食道瘻孔,頸動脈露出のある症例ではリスクが高い.組織型別では特に未分化癌に多い.
〔杉谷 巌〕
■文献
Xing M: Molecular pathogenesis and mechanisms of thyroid cancer. Nat Rev Cancer, 2013; 13: 184–199.
下方智也,安藤雄一:甲状腺癌の分子標的治療.日本甲状腺学会雑誌,2015; 6: 30–36.
清田尚臣:分化型甲状腺癌に対する分子標的薬の現状と展望.内分泌甲状腺外会誌,2016; 33: 140–144.
Brose MS, Nutting CM, et al: Sorafenib in radioactive iodine–refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double–blind, phase 3 trial. Lancet, 2014; 384: 319–328.
Schlumberger M, Tahara M, et al: Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med, 2015; 372: 621–630.
Wells SA, Robinson BG, et al: Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double–blind phase III trial. J Clin Oncol, 2012; 30, 134–141.
杉谷 巌:分子標的薬導入により変わる甲状腺癌治療の現状と課題.日本臨床外科学会雑誌,2018; 79: 1–11.
Miyauchi A, Kudo T, et al: Prognostic impact of serum thyroglobulin doubling–time under thyrotropin suppression in patients with papillary thyroid carcinoma who underwent total thyroidectomy. Thyroid, 2011; 21: 707–716.