ⓔコラム5-18-1 古典的Starlingの法則と改訂Starlingの法則
古典的Starlingの法則
古典的Starlingの法則は毛細血管から間質への水の移動は静水圧較差と膠質浸透圧較差によって決定されているというものである.すなわち,体液の移動量は,毛細血管静水圧 (Pc) と間質の静水圧 (Pi) との較差,そして毛細血管内の血漿膠質浸透圧 (πc) と間質液の膠質浸透圧 (πi) との較差により決定されるとの考え方である (図1)1,2).
体液の移動量=LpS ×(静水圧較差-浸透圧較差)
=LpS ×[(Pc-Pi)-δ(πc-πi)]
Lp:毛細血管透過性 (permeability),S:毛細血管濾過面積,Pc および Pi :毛細血管および間質液の静水圧,πc およびπi :毛細血管および間質液の膠質浸透圧,δ:毛細血管壁の蛋白透過性.
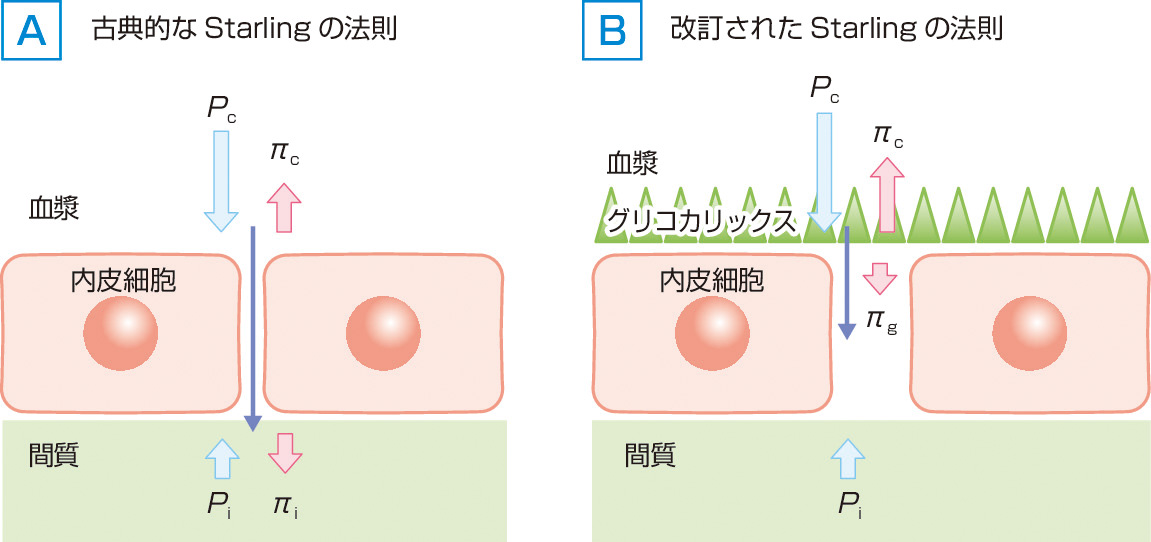
毛細血管内の静水圧は心臓から駆出された圧が伝わって形成され,水を毛細血管から間質へ押し出す力となっている.一方,血管壁を通過できない血管内の蛋白など (多くはアルブミン) によりつくられる血漿膠質浸透圧は,水を毛細血管内に引き留める力となっている.間質液の膠質浸透圧はほとんどが毛細血管を透過したアルブミンによる.毛細血管における蛋白透過性 (反発係数,reflection coefficient;δ) は0~1で表され,0の場合には自由に通過し,1の場合にはまったく通過しないことを意味する.
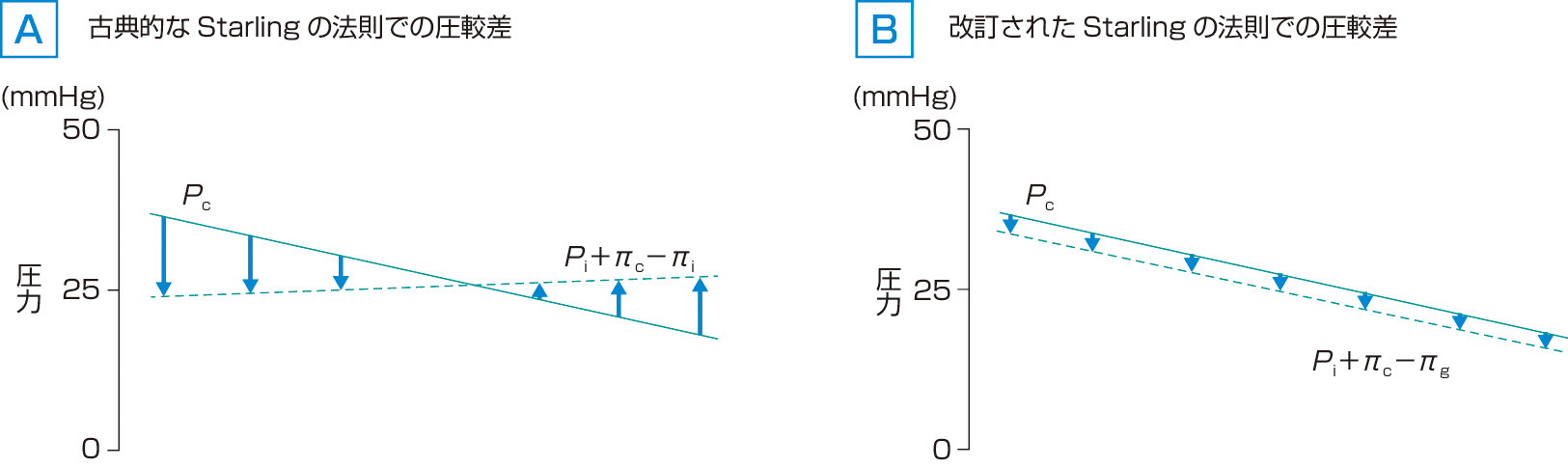
一般的に,動脈に近い側の毛細血管では動脈から伝わってきた比較的高い静水圧があり,静水圧較差>膠質浸透圧較差となるため,毛細血管内の体液は間質へ押し出される.逆に,静脈側に近い側の毛細血管では,静水圧較差はそれまでに毛細血管より体液が流れ出たために低下し,アルブミンは血管内に保持されているため毛細血管内の濃度は高まり,膠質浸透圧較差は増加する.このため,静水圧較差<膠質浸透圧較差となり,間質から毛細血管内へ体液が戻る (図2).また,毛細血管に戻りきれなかった体液はリンパ管から体循環に戻っている.このような流れで,定常状態では間質液量は一定に保持されているという考え方である.
新しく改訂されたStarlingの法則
毛細血管での濾過障壁は古典的なStarlingの法則で考えられていた単純な構造ではなく,より複雑な構造をしている.そして,この改訂されたStarlingの法則の基礎をなしているのは,この複雑な構造の要をなす血管内皮細胞上に存在し,管腔内の表面を覆っているグリコカリックスである.血管内皮のグリコカリックスは,ヘパラン硫酸,コンドロイチン硫酸,そしてデルマタン硫酸などのグリコサミノグリカンが,糖蛋白であるシンデカンやグリピカンなどに多数まとわりついたプロテオグリカンの層で,密に生えた草原のように血管の内腔を裏打ちしている.その厚さは平均で2μmとされ,アルブミンなどの血漿蛋白成分を内部に保持しているが,蛋白透過性は非常に低い3,4).
体液の毛細血管と間質との移動はこのグリコカリックス層を介して行われる.グリコカリックスの蛋白透過性は非常に低いこと,そして,静水圧較差により血管内から流れ出る体液の流れのため,間質からの蛋白成分がグリコカリックス下層領域に入り込まないこと,の2つの機序から,この領域には蛋白は存在せず膠質浸透圧は非常に低くなっている (図1).したがって,血管内に水を押し戻す力となる浸透圧較差は,血漿膠質浸透圧と間質膠質浸透圧との較差ではなく,グリコカリックス下層領域の膠質浸透圧 (πg) との較差により決定される.間質液における膠質浸透圧は血管壁を介した血管内と間質での体液の移動には関与しない.以上より,改訂されたStarlingの法則による体液の移動量は次の式で示される5-8).
体液の移動量=LpS ×[(Pc-Pi)-δ(πc-πg)]
πg:グリコカリックス下層領域の膠質浸透圧.
この改訂されたStarlingの法則の特徴は,通常の毛細血管では間質から血管内への体液の流れは,短時間での移動を除き,ほとんどみられないという点である.また,血管内から間質へ移動する体液の量は古典的Starlingの法則で計算される量よりもはるかに少なく,間質へ移行した体液のほとんどはリンパ管を経て血管内へ戻るという考えである.
毛細血管動脈側ではグリコカリックス下層領域の膠質浸透圧はほぼゼロであることより,体液の移動は主として毛細血管静水圧とアルブミンをはじめとした血漿蛋白成分を含むグリコカリックス層における膠質浸透圧との差異により決定されるため,両者の差は小さくなり,間質への流出量は少なくなる.一方,静脈側に近づくと間質圧の増加によりグリコカリックス下層領域の膠質浸透圧は少しずつ増加する.しかし,毛細血管静水圧を凌駕することはなく,体液の流れは常に間質へ向かうこととなる (図2).
毛細血管の構造は組織により大きく異なっており,内皮細胞のフェネストレーション (fenestration,窓) の有無やグリコカリックスの構造などにより4種類に分類されている (図3)9).また,蛋白透過性も各臓器により異なっている.したがって,各臓器の膠質浸透圧較差の詳細は明らかとなっていない.
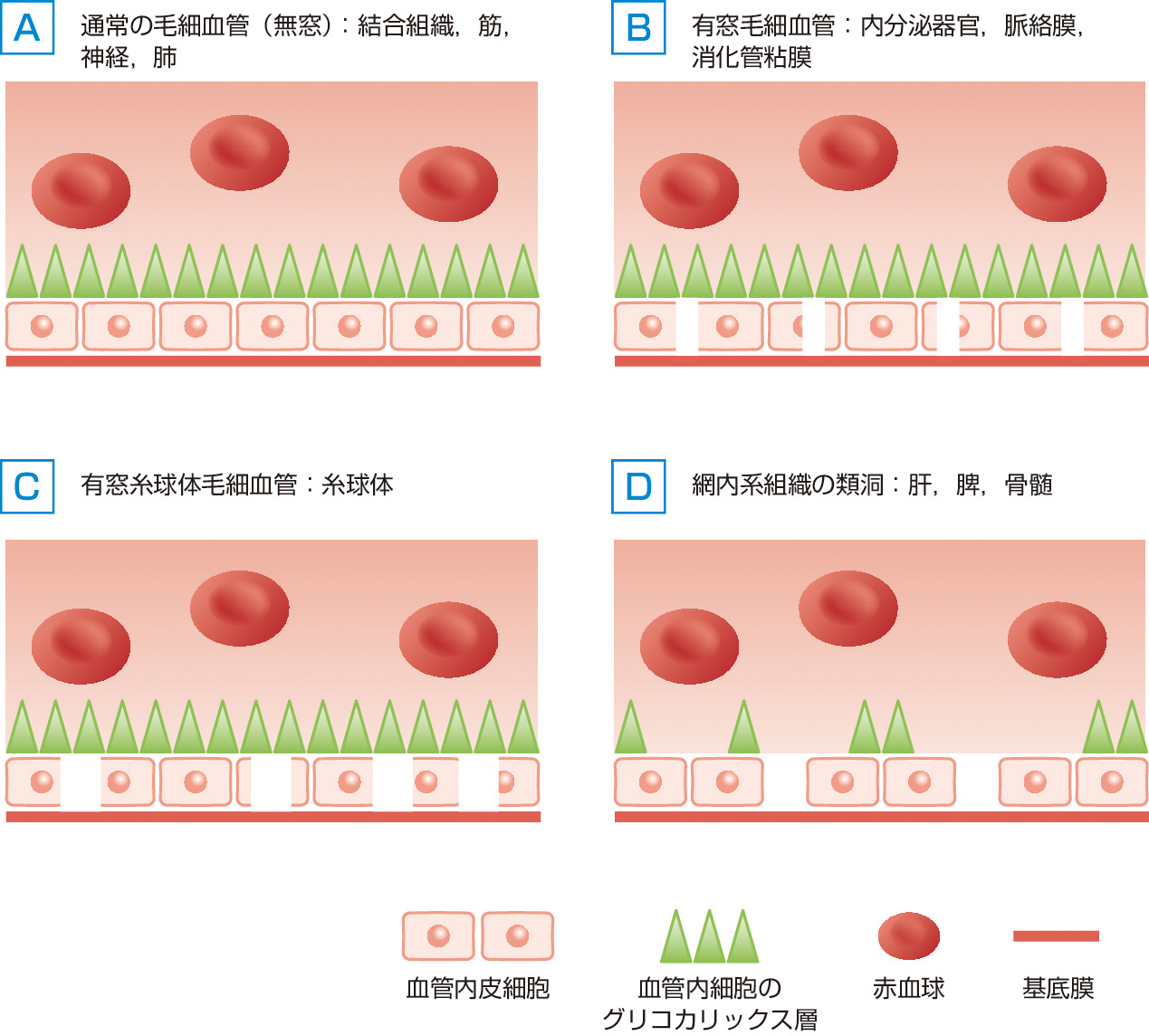
間質や筋肉などの通常の毛細血管の内皮細胞は無窓性で細胞間の間隙が非常に狭く,グリコカリックスが密に内腔を覆っている.体液はグリコカリックスの下層にある隣り合った内皮細胞の間に存在する狭い間隙を通って間質へ流れ出る.アルブミンは毛細血管の内皮細胞間の境に存在する比較的数少ない大きな孔を通って間質に拡散していると考えられており,このため,間質の膠質浸透圧は血漿の30~60%にも及び,そして,体内のアルブミンの約半分は血管外に分布しているとされている7,9).内分泌器官,脈絡膜,消化管粘膜などの毛細血管は有窓毛細血管とよばれ,内皮細胞には最大で6~12 nmの窓 (fenestra) とよばれる穴を有しているが,グリコカリックス層が全域にみられる.同じ有窓毛細血管でも消化管粘膜,腎皮質および髄質の毛細血管は例外的に間質から毛細血管内へ体液の移行が生じている.これは毛細血管静水圧が低く,間質の静水圧や毛細血管内の膠質浸透圧が高いためと考えられている.糸球体毛細血管の内皮細胞では窓空きが大きく最大で65 nm に及ぶ.限外濾過に適した構造である.肝臓の類洞ではグリコカリックスがほとんどなく,また,内皮細胞の間隙が大きいために蛋白透過性が非常に高い.したがって,浸透圧較差がなく,静水圧較差により毛細血管からの流出のみがみられる.ただし,肝血流の2/3は門脈からの供給であるために静水圧較差は骨格筋などに比して低くなっている.肺の毛細血管は蛋白透過性が高く膠質浸透圧較差も低いが,低圧灌流組織であるため静水圧較差も低くなっている.
〔安田 隆〕
■文献
Starling EH: On the absorption of fluids from the connective tissue spaces. J Physiol, 1896; 19: 312–326.
Taylor AE: Capillary fluid filtration. Starling forces and lymph flow. Circ Res, 1981; 49: 557–575.
Vink H, Duling BR: Identification of distinct luminal domains for macromolecules, erythrocytes, and leukocytes within mammalian capillaries. Circ Res, 1996; 79: 581–589.
Chappell D, Jacob M, et al: The glycocalyx of the human umbilical vein endothelial cell: an impressive structure ex vivo but not in culture. Circ Res, 2009; 104: 1313–1317.
Adamson RH, Lenz JF, et al: Oncotic pressures opposing filtration across nonfenestrated rat microvessels. J Physiol, 2004; 557: 889–907.
Becker BF, Chappell D, et al: Endothelial glycocalyx and coronary vascular permeability: the fringe benefit. Basic Res Cardiol, 2010; 105: 687–701.
Levick JR, Michel CC: Microvascular fluid exchange and the revised Starling principle. Cardiovasc Res, 2010; 87: 198–210.
Jacob M, Chappell D: Reappraising Starling: the physiology of the microcirculation. Curr Opin Crit Care, 2013; 19: 282–289.
Woodcock TE, Woodcock TM: Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy. Br J Anaesth, 2012; 108: 384–394.